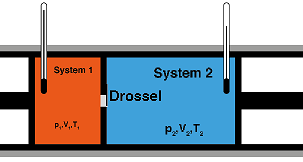
Als Joule-Thomson-Effekt bezeichne ich die Temperaturänderung eines Gases bei einer isenthalpen Druckminderung. Die Richtung und Stärke des Effekts wird durch die Stärke der anziehenden und abstoßenden Kräfte zwischen den Gasmolekülen bestimmt. Unter Normalbedingungen gilt für die meisten Gase und Gasgemische, z. B. für Luft, dass die Temperatur bei der Entspannung sinkt. Dagegen steigt sie z. B. bei Wasserstoff, Helium, Neon. In einem idealen Gas gibt es keine molekularen Kräfte, infolgedessen zeigt es keinen Joule-Thomson-Effekt. Der Joule-Thomson-Effekt spielt eine wichtige Rolle in der Thermodynamik von Gasen. Beispiele von Auftreten und Anwendungen: ##Abkühlung von Sodawasser, Schlagsahne und Softeis beim Ausschäumen aus einer Druckflasche ##Gefrieren von Wasser in Beschneiungsanlagen, sogenannten Schneekanonen. Insbesondere bei Druckluftkanonen und Schneelanzen. ##Herstellung von Trockeneis beim Zahnarzt oder beim Trockeneisstrahlen (siehe Sandstrahlen) ##Gasverflüssigung im Linde-Verfahren Konstruktion,
http://systemdesign.ch/index.php/W%C3%A4rmepumpe
Die Wärmepumpe (WP) ist eine Maschine, die Wärme von einem niedrigen Temperaturniveau unter Energiezufuhr auf ein höheres Temperaturniveau transportiert. Die WP entzieht also der Umgebung Wärme, bringt diese mit Hilfe von Kompressoren auf eine höhere Temperatur und gibt sie an das Heizsystem oder die Warmwasseraufbereitung ab. Physikalisch korrekt ausgedrückt fördert die WP Entropie aus einem System mit tiefer Temperatur in ein System mit hoher Temperatur. Weil der zugeordnete Energiestrom bei tiefer Temperatur kleiner ist als bei hoher, muss die WP dem Entropiestrom eine Prozessleistung zuführen. Eine WP darf als rückwärts laufende Wärmekraftmaschine angesehen werden.